(人民日?qǐng)?bào)健康客戶端 譚琪欣) 2月12日,國(guó)家藥監(jiān)局發(fā)布公告,,按照藥品特別審批程序,,進(jìn)行應(yīng)急審評(píng)審批,附條件批準(zhǔn)輝瑞公司新冠病毒治療藥物奈瑪特韋片/利托那韋片組合包裝(即)進(jìn)口注冊(cè),。人民日?qǐng)?bào)健康客戶端不完全統(tǒng)計(jì)發(fā)現(xiàn),,包括輝瑞此次獲批的新冠口服藥在內(nèi),目前在研的新冠口服藥共有15款,,其中多款為“老藥新用”,,5款新冠口服藥已獲得緊急使用授權(quán)/上市批準(zhǔn)。
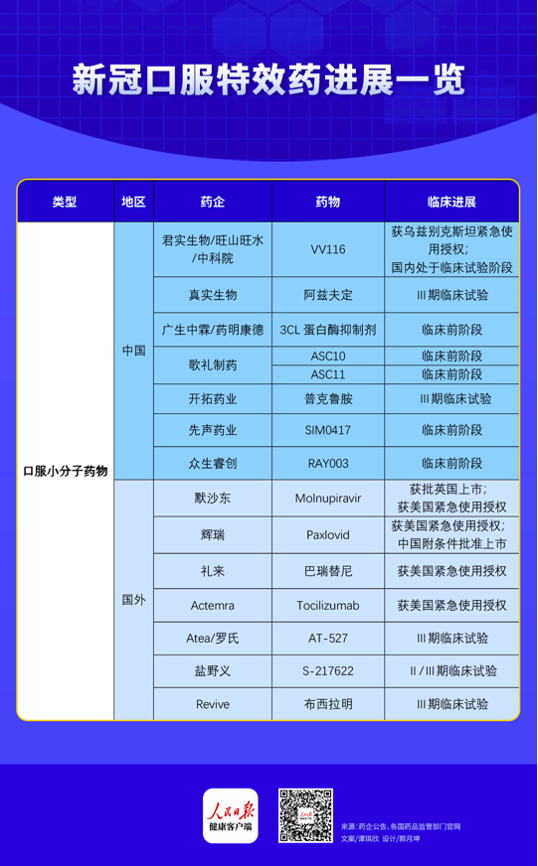

輝瑞:Paxlovid住院死亡風(fēng)險(xiǎn)降低89%,,多國(guó)緊急使用授權(quán)
據(jù)輝瑞微信公眾號(hào)消息,,Paxlovid是一款口服小分子新冠病毒治療藥物,由兩片尼馬瑞韋和一片利托那韋組成,,尼馬瑞韋可以通過抑制SARS-CoV-2蛋白來阻止病毒復(fù)制,,利托那韋可以通過減緩尼馬瑞韋的分解來維持藥效。
于我國(guó)獲批前,,美國(guó)當(dāng)?shù)貢r(shí)間2021年12月22日,,美國(guó)食品藥品監(jiān)督管理局(FDA)已向輝瑞的Paxlovid(由尼馬瑞韋片和利托那韋片共同組成)頒發(fā)了緊急使用授權(quán)(EUA),用于12歲以上,、體重40kg以上輕度至中度新冠患者,,以及有發(fā)展成新冠重癥(包括住院或死亡)的高風(fēng)險(xiǎn)人群。
支持Paxlovid獲得美國(guó)FDA緊急使用授權(quán)批準(zhǔn)的主要數(shù)據(jù)來自一項(xiàng)隨機(jī),、雙盲,、安慰劑對(duì)照臨床試驗(yàn)。數(shù)據(jù)表明,,與安慰劑相比,,在癥狀出現(xiàn)的三天內(nèi)(主要終點(diǎn)),接受Paxlovid治療的成人與COVID-19相關(guān)的住院或因任何原因死亡的風(fēng)險(xiǎn)降低了89%,。在癥狀出現(xiàn)后5天內(nèi)接受治療的患者(次要終點(diǎn))中,,住院或因任何原因死亡的風(fēng)險(xiǎn)降低了88%,并且在治療組中沒有觀察到死亡,。
除美國(guó)以外,,歐洲藥品管理局(EMA)人用醫(yī)藥產(chǎn)品委員會(huì)在2021年12月16日發(fā)布建議,支持歐盟成員國(guó)在獲得歐盟有條件營(yíng)銷授權(quán)之前,,緊急使用Paxlovid,。
默沙東:全球首個(gè)獲批上市的新冠口服藥,將住院或死亡風(fēng)險(xiǎn)降低約30%
另一款備受矚目的新冠口服藥物Molnupiravir則是“老藥新用”的典型案例,。早在2021年11月4日,,默沙東就宣布英國(guó)藥品和保健產(chǎn)品監(jiān)管局已批準(zhǔn)Molnupiravir在英國(guó)上市,,用于治療輕至中度COVID-19成人患者,Molnupiravir也由此成為全球首個(gè)獲批上市的新冠口服藥,。
2021年12月23日,,Molnupiravir獲美國(guó)食品藥品監(jiān)督管理局緊急使用授權(quán),,用于治療SARS-CoV-2病毒直接檢測(cè)結(jié)果呈陽(yáng)性的成人輕中度冠狀病毒病(COVID-19),,并且有發(fā)展為嚴(yán)重COVID-19的高風(fēng)險(xiǎn),包括住院或死亡,,以及FDA授權(quán)的COVID-19替代治療方案無法獲得或臨床上不合適的人,。
根據(jù)III期MOVe-OUT臨床試驗(yàn)中期分析結(jié)果,Molnupiravir可將進(jìn)展為重癥或死亡的風(fēng)險(xiǎn)降低了50%,,且將死亡率拉低至0%,。不過,根據(jù)默沙東提交給美國(guó)FDA的最終數(shù)據(jù),,該藥可將未接種疫苗的高風(fēng)險(xiǎn)人群住院或死亡風(fēng)險(xiǎn)降低約為30%,。
禮來:巴瑞替尼可在標(biāo)準(zhǔn)療法基礎(chǔ)上將死亡風(fēng)險(xiǎn)降低38%
巴瑞替尼也是一款“老藥”,此前在美國(guó)獲批用于治療中度至重度類風(fēng)濕性關(guān)節(jié)炎(RA)和特應(yīng)性皮炎成人患者,。疫情期間,,英國(guó)人工智能公司BenevolentAI通過其研發(fā)的AI平臺(tái)檢索海量科學(xué)文獻(xiàn),發(fā)現(xiàn)巴瑞替尼或可用于治療新冠,。
目前,,巴瑞替尼已獲得美國(guó)FDA緊急使用授權(quán),用于治療需要輔助供氧,、無創(chuàng)或有創(chuàng)機(jī)械通氣或體外膜肺氧合(ECMO)的2歲以上新冠患者以及與瑞德西韋聯(lián)用,。
2021年4月,禮來公布的一項(xiàng)覆蓋1525名患者的臨床試驗(yàn)數(shù)據(jù)顯示,,相比包括地塞米松,、瑞德西韋的標(biāo)準(zhǔn)療法,巴瑞替尼在此基礎(chǔ)上使新冠肺炎患者的死亡風(fēng)險(xiǎn)降低了38%,。但這一試驗(yàn)也發(fā)現(xiàn),,在防止患者病程惡化至呼吸器或死亡這一目標(biāo)上,巴瑞替尼沒有顯著效果,。
君實(shí)生物:國(guó)際多中心II/III期臨床試驗(yàn)正在進(jìn)行中,,已在烏茲別克斯坦獲緊急使用授權(quán)
VV116是一款口服核苷類抗新冠病毒藥物,由君實(shí)生物與旺山旺水合作開發(fā),。VV116與另一款新冠治療藥物瑞德西韋淵源頗深,,VV116根據(jù)瑞德西韋改造而來,主要是在保持抗冠狀病毒活性的前提下,,通過前藥策略改善其口服生物利用度,。
目前,,VV116已在烏茲別克斯坦獲緊急使用授權(quán)。人民日?qǐng)?bào)健康客戶端從君實(shí)生物獲悉,,VV116正在開展全球多中心臨床研究,,其中3項(xiàng)在中國(guó)開展的I期研究已于近日完成,初步結(jié)果顯示臨床安全性良好,,針對(duì)輕中度COVID-19患者的國(guó)際多中心II/III期臨床試驗(yàn)正在進(jìn)行中,。年內(nèi)通過臨床試驗(yàn)后,將第一時(shí)間啟動(dòng)上市(NDA)申請(qǐng),。
臨床前的藥代動(dòng)力學(xué)等研究結(jié)果顯示,,VV116具有很高的口服生物利用度,其口服吸收后,,迅速代謝為母體核苷,,并在體內(nèi)組織廣泛分布。VV116在體外對(duì)SARS-CoV-2原始株和已知突變株都表現(xiàn)出顯著的抗病毒作用,。在小鼠模型上,,低劑量的VV116即可將肺部病毒滴度降低至檢測(cè)限以下,可顯著改善肺組織病理變化,,表現(xiàn)出較強(qiáng)的抗病毒功效,。
開拓藥業(yè):Ⅲ期臨床試驗(yàn)已完成中國(guó)首例受試者入組及給藥
普克魯胺為開拓藥業(yè)開發(fā)的新冠口服小分子藥,據(jù)開拓藥業(yè)公告,,2月10日,,開普克魯胺治療輕中癥新冠患者全球多中心Ⅲ期臨床試驗(yàn)已在深圳市第三人民醫(yī)院完成中國(guó)首例受試者入組及給藥。
此前,,2021年12月27日,,開拓藥業(yè)曾發(fā)布公告稱普克魯胺在全球III期臨床試驗(yàn)中未達(dá)到統(tǒng)計(jì)學(xué)顯著性,開拓藥業(yè)預(yù)計(jì)調(diào)整臨床試驗(yàn)設(shè)計(jì),,繼續(xù)招募只有基礎(chǔ)性疾病和/或無新冠疫苗接種史的高風(fēng)險(xiǎn)新冠患者,。
與其他藥物不同,公開資料顯示,,普克魯胺最早是開拓藥業(yè)擬用于治療前列腺癌和乳腺癌的一款藥物,。經(jīng)系列研究后發(fā)現(xiàn),普克魯胺可以通過下調(diào)新冠病毒入侵宿主細(xì)胞的兩個(gè)關(guān)鍵蛋白的表達(dá)水平,,阻止新冠病毒入侵宿主細(xì)胞,,對(duì)新冠感染早期和中后期也有很好的療效。
普克魯胺在海外Ⅲ期臨床試驗(yàn)中的數(shù)據(jù)相當(dāng)亮眼,。開拓藥業(yè)資料顯示,,普克魯胺預(yù)防輕癥轉(zhuǎn)為重癥的住院保護(hù)率,男女分別為92%和90%,ICU或死亡保護(hù)率均為100%,;普克魯胺可以加快病毒的清除,,用藥7天后病毒陽(yáng)性轉(zhuǎn)陰率為82%(安慰劑組為31%)。普克魯胺在巴西的針對(duì)重癥新冠患者的III期臨床試驗(yàn)結(jié)果顯示,,普克魯胺將重癥新冠患者死亡風(fēng)險(xiǎn)降低了78%,,入組至康復(fù)出院中位時(shí)間縮短了5天。
此外,,2021年7月,,普克魯胺在巴拉圭獲得首個(gè)緊急使用授權(quán)。
真實(shí)生物:阿茲夫定初步臨床試驗(yàn)患者4天內(nèi)首次核酸轉(zhuǎn)陰率達(dá)90%
阿茲夫定由真實(shí)生物研發(fā),,是國(guó)產(chǎn)新冠病毒口服藥物的代表性藥物之一,,目前正在中國(guó)、巴西,、俄羅斯開展III期臨床。同時(shí),,據(jù)公開資料顯示,,阿茲夫定也是全球首個(gè)雙靶點(diǎn)抗艾滋病1類新藥,曾獲得中國(guó)專利金獎(jiǎng),。
據(jù)真實(shí)生物公眾號(hào)消息,,早在2020年新冠疫情爆發(fā)之初,阿茲夫定就開展了治療COVID-19的相關(guān)探索,,通報(bào)會(huì)上披露,,初步臨床試驗(yàn)中,10位患者4天內(nèi)第一次核酸轉(zhuǎn)陰率達(dá)到90%,。
2021年12月,,中國(guó)醫(yī)科院蔣建東等研究顯示,阿茲夫定(FNC)單磷酸鹽類似物抑制SARS-CoV-2和HCoV-OC43冠狀病毒,;大鼠試驗(yàn)中FNC三磷酸(活性形式)集中在胸腺和外周血單核細(xì)胞中,。一項(xiàng)隨機(jī)單臂試驗(yàn)中,31名患者口服FNC后在3.29~2.22天內(nèi)全部實(shí)現(xiàn)病毒核糖核酸檢測(cè)轉(zhuǎn)陰,;在9.00~4.93天內(nèi)全部出院,。
目前,阿茲夫定用于輕癥新冠感染者的巴西Ⅲ期臨床試驗(yàn)已于2021年7月完成,,用于治療中,、重度新冠肺炎的巴西Ⅲ期臨床試驗(yàn)正在進(jìn)行中;中國(guó)臨床試驗(yàn)注冊(cè)中心數(shù)據(jù)則顯示,,2021年11月,,鄭州大學(xué)第一附屬醫(yī)院已注冊(cè)了阿茲夫定開展針對(duì)Delta變異株的Ⅲ期臨床試驗(yàn)。













網(wǎng)友評(píng)論